 Nos recherches portent sur la compréhension des mécanismes moléculaires par lesquels les mutations de la rhodopsine, et des gènes qui régulent son trafic, conduisent à des maladies rétiniennes. La rhodopsine est un constituant majeur des membranes photosensibles des cellules photoréceptrices à bâtonnets rétiniens, où elle fonctionne comme un GPCR photosensible qui initie la cascade de phototransduction. La rhodopsine est également un régulateur central de la santé des photorécepteurs et est sujette à plus de 150 mutations différentes qui provoquent la rétinite pigmentaire. Les mutations qui affectent la rhodopsine C-terminale provoquent des formes sévères de rétinite pigmentaire autosomique dominante (ADRP). Au cours de nos recherches, nous avons défini le motif VxPx C-terminal de la rhodopsine comme un signal de ciblage ciliaire conservé (CTS). Nous avons identifié les constituants du complexe de ciblage ciliaire qui reconnaît ce signal pour réguler le trafic de rhodopsine et le renouvellement de la membrane des photorécepteurs en bâtonnets rétiniens.
Nos recherches portent sur la compréhension des mécanismes moléculaires par lesquels les mutations de la rhodopsine, et des gènes qui régulent son trafic, conduisent à des maladies rétiniennes. La rhodopsine est un constituant majeur des membranes photosensibles des cellules photoréceptrices à bâtonnets rétiniens, où elle fonctionne comme un GPCR photosensible qui initie la cascade de phototransduction. La rhodopsine est également un régulateur central de la santé des photorécepteurs et est sujette à plus de 150 mutations différentes qui provoquent la rétinite pigmentaire. Les mutations qui affectent la rhodopsine C-terminale provoquent des formes sévères de rétinite pigmentaire autosomique dominante (ADRP). Au cours de nos recherches, nous avons défini le motif VxPx C-terminal de la rhodopsine comme un signal de ciblage ciliaire conservé (CTS). Nous avons identifié les constituants du complexe de ciblage ciliaire qui reconnaît ce signal pour réguler le trafic de rhodopsine et le renouvellement de la membrane des photorécepteurs en bâtonnets rétiniens.
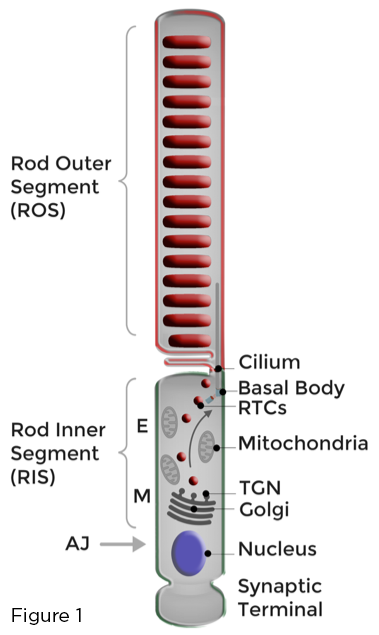 Le fondement du fonctionnement optimal des photorécepteurs à bâtonnets est la stricte compartimentation des membranes photosensibles chargées de rhodopsine au cil primaire modifié de manière unique qui forme le segment externe du bâtonnet (ROS). L'homéostasie des photorécepteurs en bâtonnets est maintenue par le réapprovisionnement continu des membranes ROS endommagées par la lumière et la séquestration efficace des protéines ROS et des lipides impliqués dans la phototransduction, loin de ceux engagés dans diverses fonctions cellulaires se déroulant dans le corps cellulaire adjacent nommé segment interne de bâtonnet (RIS), ou à l'extrémité synaptique du bâtonnet. L'appareil de Golgi et d'autres organites biosynthétiques sont localisés dans le RIS, dans la région myoïde (M). Le trafic membranaire polarisé dans les bâtonnets rétiniens implique la synthèse, le tri et le transport, à travers le RIS, d'une quantité prodigieuse de transporteurs de rhodopsine (RTC) dirigés par Golgi vers les cils. Les RTC traversent la région ellipsoïde (E) remplie de mitochondries et fusionnent avec la membrane plasmique RIS à proximité du cil. Les membranes nouvellement synthétisées sont ensuite livrées au ROS (Figure 1).
Le fondement du fonctionnement optimal des photorécepteurs à bâtonnets est la stricte compartimentation des membranes photosensibles chargées de rhodopsine au cil primaire modifié de manière unique qui forme le segment externe du bâtonnet (ROS). L'homéostasie des photorécepteurs en bâtonnets est maintenue par le réapprovisionnement continu des membranes ROS endommagées par la lumière et la séquestration efficace des protéines ROS et des lipides impliqués dans la phototransduction, loin de ceux engagés dans diverses fonctions cellulaires se déroulant dans le corps cellulaire adjacent nommé segment interne de bâtonnet (RIS), ou à l'extrémité synaptique du bâtonnet. L'appareil de Golgi et d'autres organites biosynthétiques sont localisés dans le RIS, dans la région myoïde (M). Le trafic membranaire polarisé dans les bâtonnets rétiniens implique la synthèse, le tri et le transport, à travers le RIS, d'une quantité prodigieuse de transporteurs de rhodopsine (RTC) dirigés par Golgi vers les cils. Les RTC traversent la région ellipsoïde (E) remplie de mitochondries et fusionnent avec la membrane plasmique RIS à proximité du cil. Les membranes nouvellement synthétisées sont ensuite livrées au ROS (Figure 1).
Le tri en RTC est régulé par les petites GTPases des familles Rab et Arf qui jouent un rôle central dans l'organisation du trafic membranaire intracellulaire ainsi que la livraison membranaire aux cils primaires. Les protéines impliquées dans la formation et le maintien des cils sont codées par environ 25 % des gènes de maladies rétiniennes héréditaires, avec des mutations provoquant une dégénérescence rétinienne, des reins kystiques, l'obésité et des anomalies du tube neural dans un large éventail de troubles génétiques, collectivement connus sous le nom de ciliopathies.
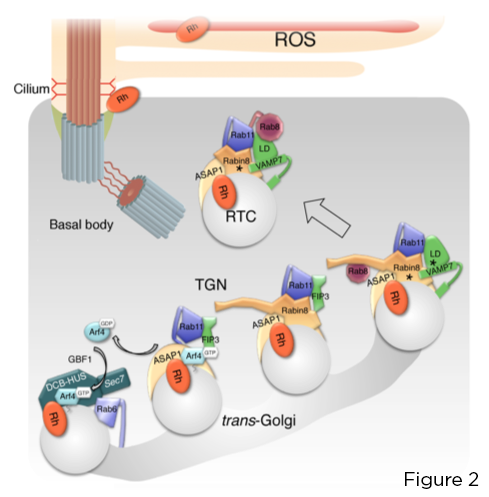 La petite GTPase Arf4 reconnaît et se lie directement à la rhodopsine C-terminale VxPx CTS. Arf4, activé au niveau du photorécepteur Golgi par le facteur d'échange de nucléotides guanine Arf (GEF) GBF1, initie un assemblage par étapes du lien de ciblage centré sur la protéine d'activation de la GTPase Arf (GAP) ASAP1, qui médie l'hydrolyse du GTP sur Arf4, et le Rab11a -Complexe effecteur double FIP3-Rabin8. Ce complexe contrôle l'assemblage du module de ciblage Rab11a-Rabin8-Rab8 hautement conservé qui recrute directement le R-SNARE VAMP7 sur les RTC pour réguler leur fusion à la base ciliaire, via l'appariement VAMP7 avec la membrane plasmique apparentée SNAREs syntaxine 3 et SNAP-25 (Figure 2).
La petite GTPase Arf4 reconnaît et se lie directement à la rhodopsine C-terminale VxPx CTS. Arf4, activé au niveau du photorécepteur Golgi par le facteur d'échange de nucléotides guanine Arf (GEF) GBF1, initie un assemblage par étapes du lien de ciblage centré sur la protéine d'activation de la GTPase Arf (GAP) ASAP1, qui médie l'hydrolyse du GTP sur Arf4, et le Rab11a -Complexe effecteur double FIP3-Rabin8. Ce complexe contrôle l'assemblage du module de ciblage Rab11a-Rabin8-Rab8 hautement conservé qui recrute directement le R-SNARE VAMP7 sur les RTC pour réguler leur fusion à la base ciliaire, via l'appariement VAMP7 avec la membrane plasmique apparentée SNAREs syntaxine 3 et SNAP-25 (Figure 2).
Au cœur de la cascade ciliaire Rab11a-Rabin8-Rab8 se trouve la Rab8 GEF Rabin8, une protéine d'échafaudage multifonctionnelle qui interagit avec certaines protéines ciliaires, telles que le complexe de trafic TRAPPII et le BBSome, suggérant un rôle central dans les voies ciliaires des récepteurs sensoriels. Sa fonction est affectée par des mutations de la kinase NDR2 (STK38L), codée par le gène de dégénérescence rétinienne précoce (erd) canine correspondant à la ciliopathie humaine de Leber amaurose congénitale (LCA). Notre étude actuelle montre que la GFP-Rabin8 humaine exprimée en transgénique X. laevis colocalise avec Rabin8 endogène et la rhodopsine au Golgi et sur les RTC, ouvrant la voie à de futures études sur le rôle de Rabin8 dans la progression membranaire le long de la voie ciliaire, qui est potentiellement perturbée dans les maladies dégénératives rétiniennes héréditaires.
Collectivement, nos études ont révélé que le ciblage membranaire des ROS est une forme conservée de ciblage ciliaire. Le motif VxPx est présent dans d'autres protéines membranaires ciliaires. Le complexe de ciblage conservé à base d'Arf4 cible les récepteurs sensoriels des cils primaires à travers des réseaux fonctionnels complexes de petites GTPases et leurs régulateurs qui sont extrêmement sensibles aux mutations provoquant des dégénérescences rétiniennes et des ciliopathies.
Deretic D., Lorentzen E et Fresquez T. (2019). Les tenants et aboutissants du complexe de ciblage de la membrane ciliaire à base d'Arf4. Petits GTPases. Petits GTPases. 2019 mai 9 : 1-12. doi: 10.1080/21541248.2019.1616355. [Publication électronique avant impression]
Kandachar V, Tam BM, Moritz OL et Deretic D. (2018) Un réseau d'interaction entre le SNARE VAMP7 et les Rab-GTPases au sein d'un complexe de ciblage de la membrane ciliaire. J Cell Sci. (2018) J Cell Sci. 2018 décembre 10 ;131(24). pii : jcs222034. doi: 10.1242/jcs.222034.
Wang J., Fresquez T. Kandachar V. et Deretic D (2017). L'Arf GEF GBF1 et l'Arf4 agissent en synergie avec la cargaison de récepteurs sensoriels, la rhodopsine, pour réguler le trafic membranaire ciliaire. J Cell Sci. J Cell Sci. 2017er décembre 1 ; 130(23 : 3975-3987). doi: 10.1242/jcs.205492. Publication en ligne du 2017 oct. 12
Vetter M, Wang J, Lorentzen E et Deretic D. (2015) Nouvelle topographie du réseau d'interaction Rab11-effecteur au sein d'un complexe de ciblage de la membrane ciliaire. Petites GTPases. 2015 octobre 2; 6(4):165-73. doi: 10.1080/21541248.2015.1091539. Publication en ligne du 2015 septembre 23.
Wang J et Deretic D. (2015) L'effecteur FIP11 Arf et Rab3 agit en synergie avec l'Arf GAP ASAP1 pour diriger Rabin8 dans le ciblage des récepteurs ciliaires. J Cell Sci. J Cell Sci jcs.162925; Article avancé en ligne 11 février 2015, doi:10.1242/jcs.162925 (2015).
Wang J. et Deretic D (2014). Complexes moléculaires qui dirigent le transport de la rhodopsine vers les cils primaires. Prog Retin Eye Res. 2014 janvier ; 38 : 1-19. doi: 10.1016/j.preteyeres.2013.08.004. Publication en ligne du 2013 octobre 14
Wang J, Morita Y, Mazelova J et Deretic D. (2012). L'Arf GAP ASAP1 fournit une plate-forme pour réguler le ciblage des récepteurs ciliaires médiés par Arf4 et Rab11-Rab8. EMBO J 31, 4057-4071.
Mazelova J, Ransom N, Astuto-Gribble L, Wilson MC et Deretic D. (2009) L'appariement Syntaxin 3 et SNAP-25, régulé par l'acide docosahexaénoïque oméga-3 (DHA), contrôle la délivrance de rhodopsine pour la biogenèse des cils. organites sensoriels dérivés, les segments externes de la tige. J. Cell Sci. 122, 2003-2013.
Mazelova J, Astuto-Gribble L, Inoue H, Tam BM, Schonteich E, Prekeris R, Moritz OL, Randazzo PA et Deretic D. (2009) Le motif de ciblage ciliaire VxPx dirige l'assemblage d'un module de trafic via Arf4. EMBO J. 28, 183-192.
Deretic D, Williams AH, Ransom N, Morel V, Hargrave PA et Arendt A. (2005) La Rhodopsine C-terminale, le site des mutations causant la maladie rétinienne, régule le trafic en se liant à ARF4. Proc. Natl. Acad. Sci. ETATS-UNIS. 102: 3301-3306.