Laboratoire Bradfute

Maladies infectieuses/agents pathogènes tels que ceux qui sont récemment apparus dans une population ou qui ont existé mais dont l'incidence ou l'étendue géographique augmentent rapidement

La souris sylvestre Peromyscus maniculatus est porteuse du hantavirus Sin Nombre, responsable de la plupart des cas de syndrome cardiopulmonaire à hantavirus aux États-Unis.
Crédit photo : Sam Goodfellow

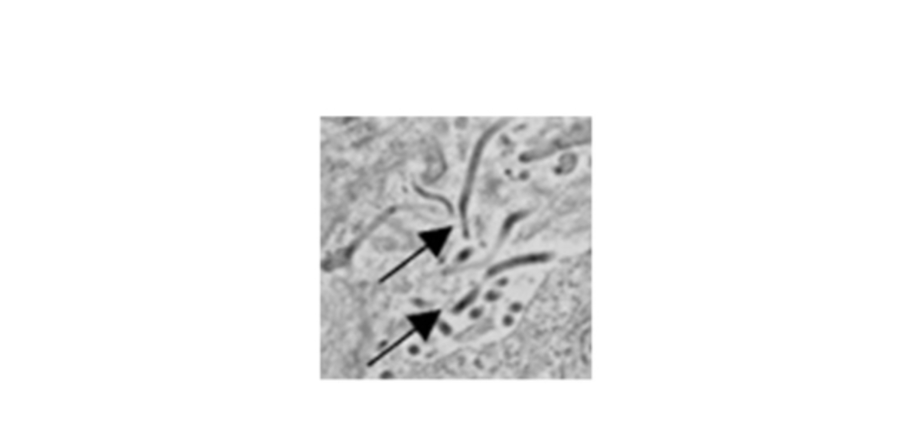
Virus Ebola dans la rate infectée. Les flèches indiquent les virions individuels. Imagerie réalisée en microscopie électronique à transmission.
Crédit photo : Steven Bradfute, PhD

Test de plaque du virus Zika pour identifier les anticorps neutralisants
Crédit photo : Steven Bradfute, PhD
L'infection par le virus Ebola provoque la mort des cellules immunitaires. La microscopie à fluorescence montre des cellules spléniques d'un animal infecté. Le rouge marque les cellules mourantes et montre toutes les cellules.
Crédit photo : Steven Bradfute, PhD
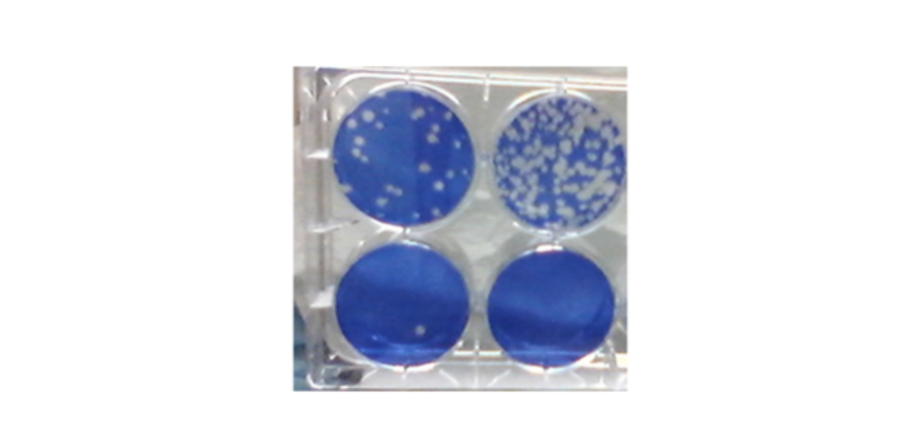
Test de plaque SARS-CoV-2 pour mesurer l'inhibition de la réplication du coronavirus. La couleur bleue est celle des cellules vivantes ; les trous blancs sont des « plaques montrant où le SRAS-CoV-2 a infecté et tué des cellules.
Crédit photo : Steven Bradfute, PhD
Les hantavirus sont des agents pathogènes dangereux qui provoquent des maladies graves chez l'homme. Les virus se répliquent sans danger chez les rongeurs et sont transmis aux humains par inhalation de virus dans les excréments de rongeurs en aérosol. Le premier hantavirus pathogène aux États-Unis, le hantavirus Sin Nombre, a été découvert au Nouveau-Mexique en 1993. Le Nouveau-Mexique a eu le plus de cas de hantavirus Sin Nombre que tout autre État, ce qui en fait un virus important pour notre région, surtout compte tenu de sa létalité élevée. taux chez l'homme (~35%). Nos recherches couvrent de multiples domaines de la biologie et de la thérapeutique des hantavirus.
-Anticorps neutralisants pour la thérapeutique.
Nous avons un effort de collaboration dans le cadre d'une subvention NIH U19 basée sur Albert Einstein College of Medicine pour identifier et analyser les anticorps monoclonaux contre plusieurs hantavirus. Ces données sont utilisées par le consortium pour sélectionner des anticorps afin de tester leur capacité à sauver de petits modèles animaux de l'infection. Cette étude collaborative est mise en avant dans le podcast « This Week in Virology » : https://www.microbe.tv/twiv/twiv-578/
--Réponses immunitaires à mémoire à long terme chez les survivants de l'hantavirus Sin Nombre.
Nous suivons les réponses immunitaires à long terme chez les survivants de l'hantavirus Sin Nombre. À ce jour, nous avons trouvé des réponses d'anticorps très fortes chez les survivants, avec des patients jusqu'à 23 après l'infection montrant toujours des réponses d'anticorps neutralisants détectables. Ces données suggèrent que les survivants de l'hantavirus génèrent une immunité forte et durable contre la réinfection. Nous avons également établi un test de cytométrie en flux à 13 couleurs pour tester les réponses de rappel spécifiques de l'hantavirus dans plusieurs compartiments de cellules T CD8+ et CD4+ à mémoire.
--Analyse génétique du virus Sin Nombre chez des rongeurs capturés dans la nature au Nouveau-Mexique.
Le rongeur hôte de l'hantavirus Sin Nombre est la souris sylvestre Peromyscus maniculatus. Les souris sylvestres ont une aire de répartition naturelle très étendue, car on les trouve dans presque tous les États-Unis (à l'exception des régions du sud-est). Cependant, l'infection par le virus Sin Nombre chez l'homme est principalement concentrée dans l'ouest et le sud-ouest des États-Unis. Nous posons la question « pourquoi les souris sylvestres sont-elles partout mais pas les humains infectés ? » Nous répondons à cette question en piégeant des souris sylvestres dans tout le Nouveau-Mexique, à la fois dans des régions humaines endémiques et non endémiques, afin de déterminer si a) le virus Sin Nombre se trouve uniquement dans les régions endémiques des patients humains ou b) la séquence du génome du virus est sensiblement différent selon les régions.

Le laboratoire Bradfute a capitalisé sur notre expertise des pathogènes viraux émergents pour étudier le virus Zika lors de l'épidémie 2013-2016. Nous avons collaboré avec Los Alamos National Laboratories pour tester l'efficacité d'un nouveau système d'administration d'ADN/nanoparticules dans la protection des souris contre l'infection par le virus Zika. Nous avons découvert qu'un vaccin à ADN plasmidique formulé dans un nouveau système d'administration induisait une immunité protectrice contre l'infection par le virus Zika chez la souris d'une manière dose-dépendante.
Hraber P, Bradfute SB, Clarke E, Ye C et Pitard B. Copolymère amphiphile à blocs Livraison d'un vaccin à ADN contre le virus Zika. Vaccin 36:6911 (2018)

Le laboratoire Bradfute est impliqué dans le test de nouveaux vaccins pour l'induction de réponses immunitaires croisées contre plusieurs virus de l'encéphalite, qui sont transmis par les moustiques et provoquent des maladies graves chez les chevaux et les humains.
-- Délivrance d'antigènes de nanocarriers pour des vaccins alphavirus à dose unique largement protecteurs.
Nous travaillons en partenariat avec Los Alamos National Laboratories (LANL) pour tester un nouveau vaccin à base d'ADN afin de fournir une immunité unique et durable contre plusieurs alphavirus. Notre rôle dans cette collaboration est de tester des vaccins à ADN pour leur induction de réponses d'anticorps et de cellules T chez la souris, en utilisant les alphavirus BSL-3 comme cibles.
-- Longs ARN non codants dans l'infection par le virus de l'encéphalite équine vénézuélienne.
Nous venons tout juste d'obtenir une subvention pour un grand projet étudiant le rôle des ARN longs non codants dans les réponses cellulaires à l'infection par le virus de l'encéphalite équine vénézuélienne. Ce projet s'appuiera sur nos installations d'agents sélectionnés BSL-3 à l'UNM HSC pour tester quels ARN longs non codants sont exprimés après infection in vitro et in vivo d'un virus de l'encéphalite équine vénézuélienne pathogène par rapport à une version non pathogène du même virus. De cette manière, nous pourrons comparer directement quels ARN longs non codants sont induits ou supprimés dans une réponse cellulaire réussie par rapport à une réponse infructueuse.
Le virus Ebola est un agent pathogène mortel qui a un taux de mortalité de plus de 40 %. Bien que traditionnellement confiné à de petites épidémies dans des villages isolés, le virus a commencé à se propager dans les grandes villes pour la première fois, provoquant une épidémie mondiale de 2013 à 2016. Nous participons aux efforts de développement de vaccins et de traitements contre ce virus.
-Développement d'un vaccin contre le virus Ebola et de traitements thérapeutiques.
Nous avons découvert que les modifications de la glycosylation (schéma du sucre) dans la glycoprotéine virale affectent considérablement la façon dont ces protéines induisent une réponse immunitaire lorsqu'elles sont utilisées comme vaccin. Ces changements de glycosylation se produisent lorsque les vaccins sont fabriqués dans différents types de cellules. Nos résultats étaient pertinents, car différents types de cellules sont utilisés pour différents vaccins.
-Co-administration thérapeutique du virus Ebola et vaccinale.
Nos études sur le virus Ebola se sont poursuivies avec le financement récent d'une deuxième subvention, dans laquelle nous étudions comment l'administration de thérapies à court terme aux côtés de vaccins à long terme affecte l'efficacité de ces traitements. L'objectif est de déterminer le moment optimal pour donner les deux médicaments thérapeutiques pour une protection immédiate contre le virus sans abroger la protection à long terme des vaccins co-administrés

Compte tenu de l'urgence de la pandémie de coronavirus en cours, le laboratoire Bradfute a dirigé les travaux sur le virus BSL-3 SARS-CoV-2 à l'UNM HSC. Nous avons collaboré avec plus de 25 groupes universitaires et commerciaux différents pour utiliser notre spécialisation unique dans la recherche de thérapies, de vaccins, d'inactivation, de biologie fondamentale et d'analyse d'échantillons de patients pour le SRAS-CoV-2.
-- Évaluation des anticorps neutralisants chez les patients convalescents et aigus COVID-19.
Le laboratoire de Bradfute a testé les titres d'anticorps neutralisants dans le plasma de personnes convalescentes et le plasma de patients atteints de COVID-19 aigus qui avaient été perfusés avec le plasma convalescent en tant que thérapie expérimentale à l'UNMH. Nous avons constaté que bien que tous les patients convalescents testés aient des titres d'anticorps positifs contre la protéine de surface Spike lorsqu'ils sont mesurés par des tests immuno-enzymatiques (ELISA), les niveaux d'anticorps neutralisants contre le SRAS-CoV-2 vivant étaient très faibles chez les personnes convalescentes et ne pas augmenter les niveaux d'anticorps ou améliorer la progression de la maladie chez les receveurs. Cette étude a mis en évidence l'importance de présélectionner le plasma convalescent non seulement pour les anticorps totaux via ELISA, mais pour neutraliser les titres d'anticorps avant la perfusion chez les patients. Nous avons également collaboré avec TriCore Reference Laboratories pour montrer que les titres d'anticorps neutralisants sont en corrélation avec un test de détection d'anticorps simple et rapide utilisé dans le commerce qui ne nécessite pas l'utilisation de virus vivants.
-- Méthodes d'inactivation du SARS-CoV-2 sur les surfaces.
Nous avons testé plusieurs méthodes chimiques, thermiques, lumineuses et autres pour inactiver le SARS-CoV-2 vivant. Nous avons également démontré qu'une méthode couramment suggérée pour décontaminer les masques N95 avec de la chaleur sèche n'est pas efficace pour éliminer le SARS-CoV-2 vivant.
-- Analyse des réponses longitudinales des anticorps et des lymphocytes T chez les individus COVID-19 convalescents. Nous avons récemment été financés par UNM HSC CTSC pour suivre les réponses immunitaires chez les patients après leur rétablissement de l'infection par le SRAS-CoV-2. Nous avons un IRB approuvé pour ce travail et recrutons actuellement 50 patients pour analyser leurs réponses en anticorps et en lymphocytes T pendant une période pouvant aller jusqu'à 10 ans. Ce travail répondra à des questions vitales concernant la durée pendant laquelle les survivants de COVID-19 ont des réponses immunitaires contre le virus.
-- Criblage in vitro de petites molécules contre le SARS-CoV-2.
L'un des principaux aspects de mon travail sur le SRAS-CoV-2 est de tester de petites molécules pour leur efficacité in vitro contre des virus vivants dans le laboratoire BSL-3. Nous avons travaillé avec l'UNM HSC, le campus principal de l'UNM et des institutions non-UNM pour tester leurs médicaments pour l'activité antivirale. Mon laboratoire a criblé de nombreuses petites molécules et en a trouvé une poignée qui inhibe puissamment la réplication. Ce travail a donné lieu à de nombreuses soumissions de subventions ainsi qu'à des manuscrits en préparation ou soumis, dont un échantillon est répertorié ci-dessous.